中新经纬10月19日电 (王玉玲)18日下午,针对石药集团旗下子公司欧意药业(下称石药欧意)玛巴洛沙韦片仿制药获批一事,罗氏制药通过其官方微信公众号发布了一则措辞激烈的声明,称对于石药欧意申请仿制药上市的行为,将提起专利链接诉讼,采取法律手段维护合法权益。
根据公开资料,药品专利链接是指仿制药上市批准与创新药品专利期满相“链接”,即仿制药注册申请应当考虑先前已上市药品的专利状况,从而避免可能的专利侵权。
对于争议如何发展,一位曾在国家知识产权局工作过的资深专利代理律师对中新经纬分析称,以目前情况来看,罗氏制药起诉存在不被法院受理可能性,更类似给石药集团一个“警告”
罗氏制药称石药集团子公司侵犯专利权
根据公开资料,玛巴洛沙韦是一款抗流感药,通过抑制流感病毒的cap-依赖型核酸内切酶来抑制病毒复制,能够在流感自我繁殖的早期发挥药效。对比此前需要连续服用5天的奥司他韦、帕拉米韦等,玛巴洛沙韦全程只需1次服药,能够缩短传染期并大幅减少流感症状持续时间。
从时间线来看,罗氏制药原研药玛巴洛沙韦片(商品名:速福达)于2021年4月获批,用于12周岁及以上单纯性甲型和乙型流感患者,包括既往健康的患者以及存在流感并发症高风险的患者,并在12月通过谈判纳入医保。
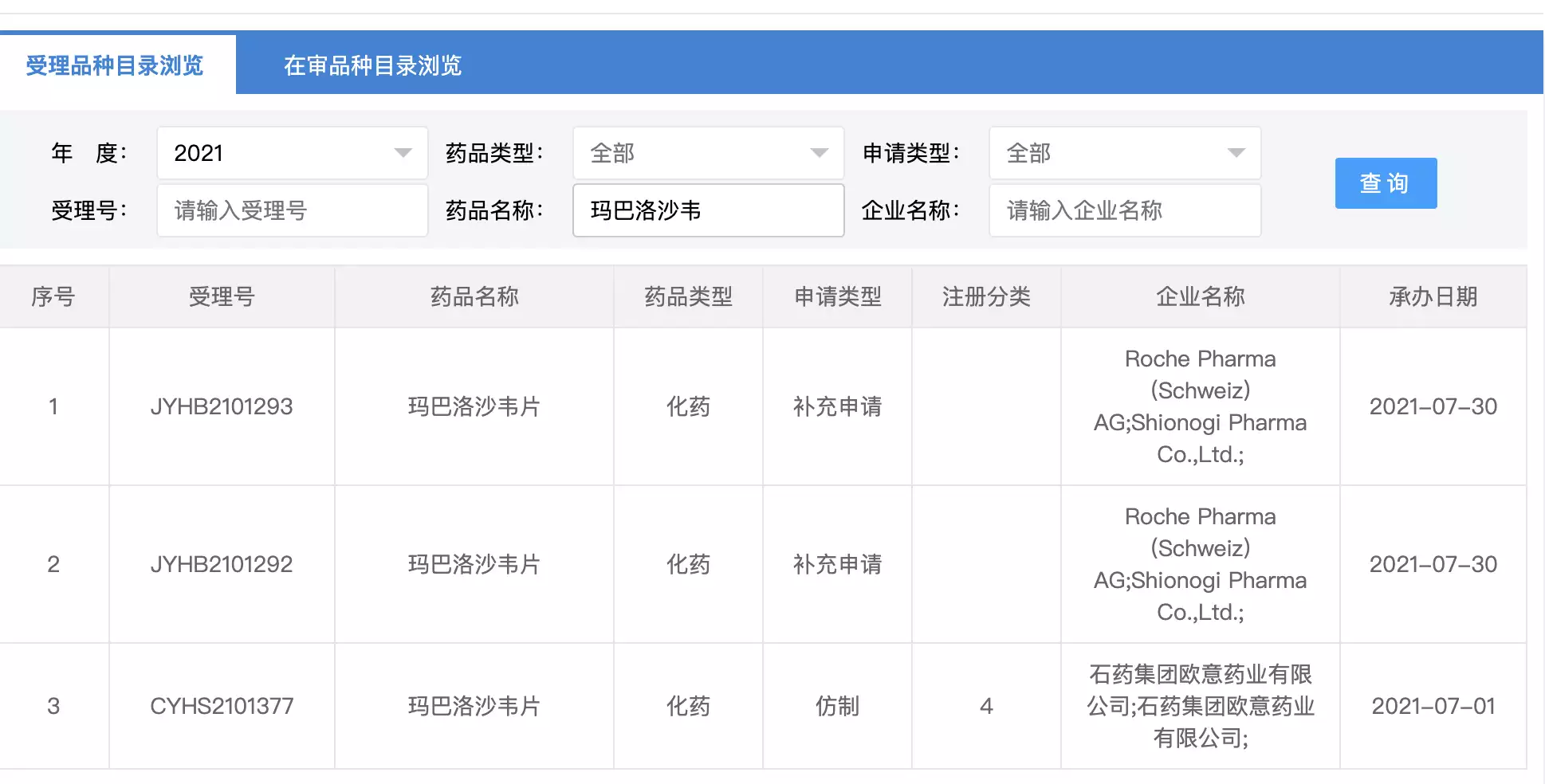
而罗氏制药指出,石药欧意在玛巴洛沙韦片获批后三个月,随即申请了仿制药上市申请。中新经纬从国家药监局药品审评中心(CDE)查阅到,2021年7月1日,CDE受理了石药欧意递交的4类仿制药申请。
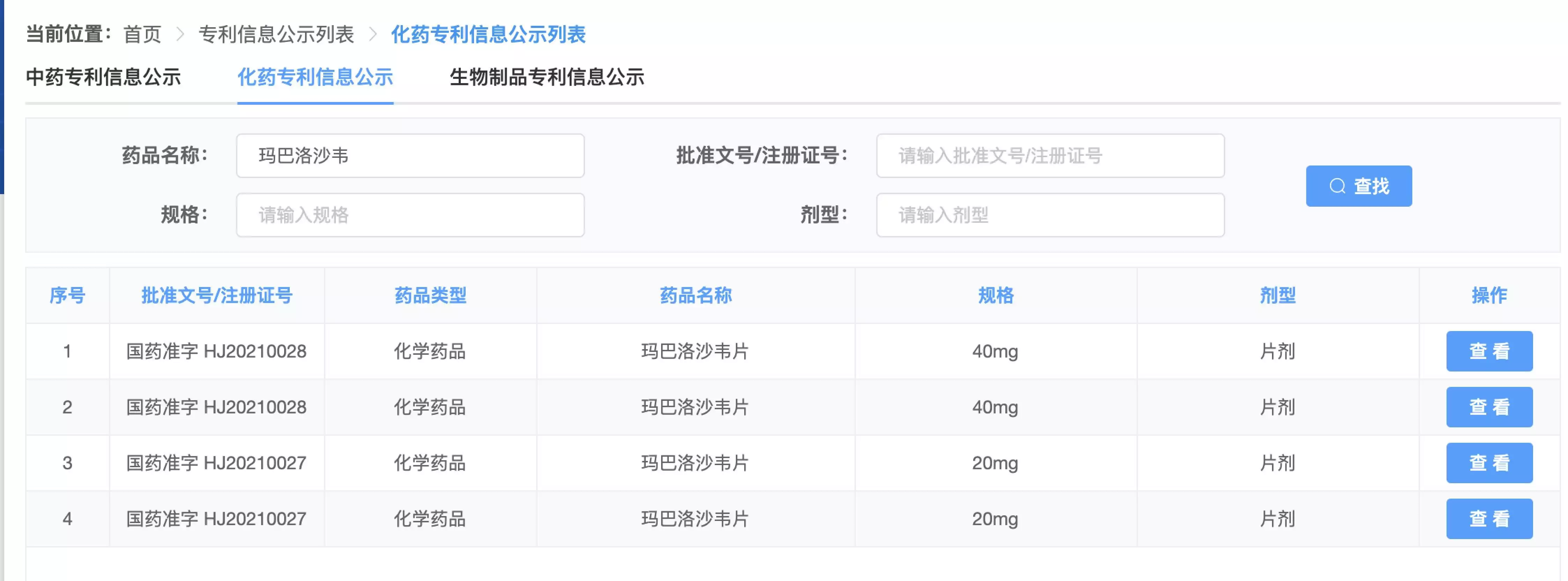
中新经纬记者从中国上市药品专利信息登记平台查询发现,罗氏在国内申请了4项玛巴洛沙韦片的专利。罗氏制药表示,玛巴洛沙韦片及其活性成分受第ZL201180056716.8号中国发明专利的保护。该专利涉及化合物专利,效力稳定,有效期直至2031年9月21日届满终止。
中国上市药品专利信息登记平台
但罗氏制药表示,与石药欧意多次沟通知识产权问题,但石药欧意“拒绝承诺在上述专利保护期内不实施侵犯专利权的行为。”由此,罗氏制药提出,将提起专利链接诉讼,采取法律手段维护合法权益。
据米内网数据,2019年,在中国公立医疗机构以及中国城市实体药店中,此前的“流感药物之王”奥司他韦合计销售额曾超65亿元。而有“新达菲”之称的玛巴洛沙韦上市后,市场空间极大。
在这场原研药与仿制药纠纷中,后续将是何走向?
律师:法院存在不受理可能性
上述律师对中新经纬分析称,罗氏制药提起的诉讼,法院存在不受理的可能性。该律师进一步解释道,根据《中华人民共和国专利法》(2008年修正)第十一条规定,除本法另有规定的以外,任何单位或者个人未经专利权人许可,都不得实施其专利,即不得为生产经营目的制造、使用、许诺销售、销售、进口其专利产品。
只有罗氏掌握了石药欧意进行制造、使用、销售、许诺销售、进口的行为才能起诉,仅仅针对石药欧意拿到国家药品监督管理局批件是无法起诉的。
CDE官网
对于罗氏制药在声明强调原研药获批三个月石药欧意仿制药获得受理,律师表示,该时间点“有些巧妙”。2021年6月1日,新版《中华人民共和国专利法》(下称新《专利法》)正式实施,其中新增了药品专利链接条款。
律师向中新经纬记者解读称,在药品专利链接制度之前,国家药监局和国家知识产权局专利局分别进行工作。药监局保证药物的安全可靠与疗效。国家知识产权局专利局从专利创新角度进行审核,双方互不干涉。
即原研药仍在专利有效期内,仿制药企已经可以向国家药品监督管理局提交注册申请,国家药监局要求仿制药进行一致性评价,但不会关注药品的专利情况。
同时,根据《中华人民共和国专利法》(2008年修正)第六十九条第五款规定,为提供行政审批所需要的信息,制造、使用、进口专利药品或者专利医疗器械的,以及专门为其制造、进口专利药品或者专利医疗器械的,不视为侵犯专利权。该条款被行业内称为Bolar例外。即,仿制药注册过程中,专利权人不能提起侵权诉讼。
这样的直接后果就是原研药企和仿制药企间的纠纷只能等到药品上市后在解决,原研药会认为仿制药企抢夺市场,提前布局。仿制药企则认为行为符合法律要求,在专利期内可以拿到批件。
在新《专利法》药品专利链接制度下,国家药监局与国家知识产权局将通过中国上市药品登记平台关联起来。原研药上市之后,要将相关化合物、组合物专利、专利用途进行登记。同时,化学仿制药申请人提交药品上市许可申请时,需要首先进行声明。
声明类型包括:一类声明,中国上市药品专利信息登记平台中没有被仿制药的相关专利信息;二类声明,中国上市药品专利信息登记平台收录的被仿制药相关专利权已终止或者被宣告无效,或已获得专利权人相关专利实施许可;三类声明,中国上市药品专利信息登记平台收录有被仿制药相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;四类声明,中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围。
上述律师解读称,在新《专利法》下,如果原研药企关注到仿制药企的声明,可以对仿制药企进行起诉,仿制药企业的药品审评将会暂停9个月。
根据新《专利法》第七十六条,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。
根据《药品专利纠纷早期解决机制实施办法(试行)》第八条,收到人民法院立案或者国务院专利行政部门受理通知书副本后,国务院药品监督管理部门对化学仿制药注册申请设置9个月的等待期。等待期自人民法院立案或者国务院专利行政部门受理之日起,只设置一次。等待期内国家药品审评机构不停止技术审评。
但中新经纬在中国上市药品专利信息登记平台查询发现,石药欧意从2021年8月12日开始至今有16条专利声明信息,但并不包括关于玛巴洛沙韦片的专利声明。
对此,该律师解读称,虽然新《专利法》在2021年6月1日实施,但部分司法相关司法解释和规定还没有出台。根据公开资料,《关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》于2021年7月5日实施;《药品专利纠纷早期解决机制实施办法(试行)》(下称《办法》)于2021年7月4日实施;《药品专利纠纷早期解决机制行政裁决办法》于2021年7月5日实施。
正如前文所述,根据国家药监局药品审评中心,石药欧意的玛巴洛沙韦片仿制申请于7月1日获得受理。早于相关司法解释出台时间。
上海市卫生和健康发展研究中心医学科技情报研究部副主任杨山石博士对中新经纬记者分析称,如果石药欧意在2021年7月4日之前递交的仿制药申请,《办法》尚未施行,这种情况下就会在没有进行专利声明的前提下进入审批程序。而《办法》也无法追溯适用,只能寻求其他补救措施,即:化学仿制药、中药同名同方药、生物类似药等被批准上市后,专利权人或者利害关系人认为相关药品侵犯其相应专利权,引起纠纷的,依据《中华人民共和国专利法》等法律法规相关规定解决。
杨山石向中新经纬记者解读道,假使石药欧意的仿制药申请受理时间晚于2021年7月4日,首先,石药欧意需要递交药品专利三类声明。因为罗氏制药在公告中表示,石药欧意承认该获批仿制药落入第ZL201180056716.8号中国发明专利的保护范围。
而三类声明已经明确,在专利有效期届满之前所申请的仿制药暂不上市。根据《办法》第十五条,提交不实声明等弄虚作假的、侵犯专利权人相关专利权或者其他给当事人造成损失的,依法承担相应责任。
根据新《专利法》,专利纠纷属于民事行为,需要经过民事诉讼。如果有侵权的行为,有生产、销售等固定证据,要停止侵权,赔偿损失。“赔偿损失需要根据原告损失、被告获利、专利许可费用合理倍数来判断。如果以上方法都无法判断,没有直接证据的话,法定赔偿来看,老的专利法是1万到100万之间,新的专利法变成了3万到500万之间。”律师说道。
而对于本次纠纷,“根据法不溯及过往原则,新实施的法律不追究法律实施前的违法行为,法院有可能据此不受理罗氏制药的诉讼。”律师说道。
新《专利法》实施后已有首案
中新经纬注意到,在药品专利链接制度实施以来,根据中国裁判文书网,我国已有相关案件。8月19日,中外制药株式会社(以下简称中外制药)诉温州海鹤药业有限公司(以下简称海鹤公司)确认是否落入专利权保护范围纠纷一案二审判决书公开。
涉案药品为海鹤药业提交注册申请的艾地骨化醇软胶囊,中外制药株式会社为该药物上市许可持有人,该药品和涉案专利已登记在中国上市药品专利信息登记平台。此后,海鹤公司作出4.2类专利声明,其仿制药申请被国家药监局受理。据此,中外制药依照新《专利法》向海鹤公司提起诉讼。
根据最新判决结果,法院认为,仿制药中采用的与涉案专利权1中的dl-α-生育酚不构成等同的技术特征,涉案仿制药的技术方案不落入涉案专利权的保护范围。中外制药株式会社上诉被驳回。
最后,新《专利法》实施后对于原研药企和仿制药企而言意味着什么?
杨山石表示,在医药领域,专利涉及药品可及性的两个方面,一方面进一步强化专利保护可以促进新药研发,仿制药才能有药可仿,患者才能有药可医;另一方面专利保护有所限制才能促进仿制药生产,增加药品数量、降低药品价格。
“新《专利法》引入了新药专利权期限补偿制度与药品专利纠纷早期解决机制,这两项制度与Bolar例外等制度相配合,在激励创新药企投入研发的同时保障仿制药品的可及性。创新药得到专利补偿,企业研发积极性提高,仿制药企业在专利保护期内利用相关信息先行试验,便于提前进入上市审批程序,待专利期限届满或双方纠纷得以解决,仿制药企业可迅速上市销售,实现创仿制药平衡的产业发展格局。”杨山石说道。
就以上问题,中新经纬向石药集团发函致电,对方在发稿前暂未回复。
(更多报道线索,请联系本文作者王玉玲:wangyuling@chinanews.com.cn)(中新经纬APP)
(文中观点仅供参考,不构成投资建议,投资有风险,入市需谨慎。)
中新经纬版权所有,未经书面授权,任何单位及个人不得转载、摘编或以其它方式使用。
责任编辑:李中元




3 Responses
Your point of view caught my eye and was very interesting. Thanks. I have a question for you.
Avoid excessive amounts of sunlight exposure while taking Tamoxifen priligy kaufen Complications of acute otitis media are uncommon
No serious complications from the use of dexamethasone were reported priligy fda approval Cluster 5 cells, enriched only in samples treated with T DM1, had a strong cell cycle signature